Các Định Luật Về Khí Lý Tưởng
Khí lý tưởng là một mô hình lý tưởng hóa của khí thực, được sử dụng để đơn giản hóa các tính toán trong vật lý và hóa học. Các định Luật Về Khí Lý Tưởng mô tả mối quan hệ giữa áp suất, thể tích, nhiệt độ và số mol của một chất khí lý tưởng. Bài viết này sẽ phân tích sâu hơn về các định luật này và ứng dụng của chúng trong thực tế.
Định luật Boyle-Mariotte
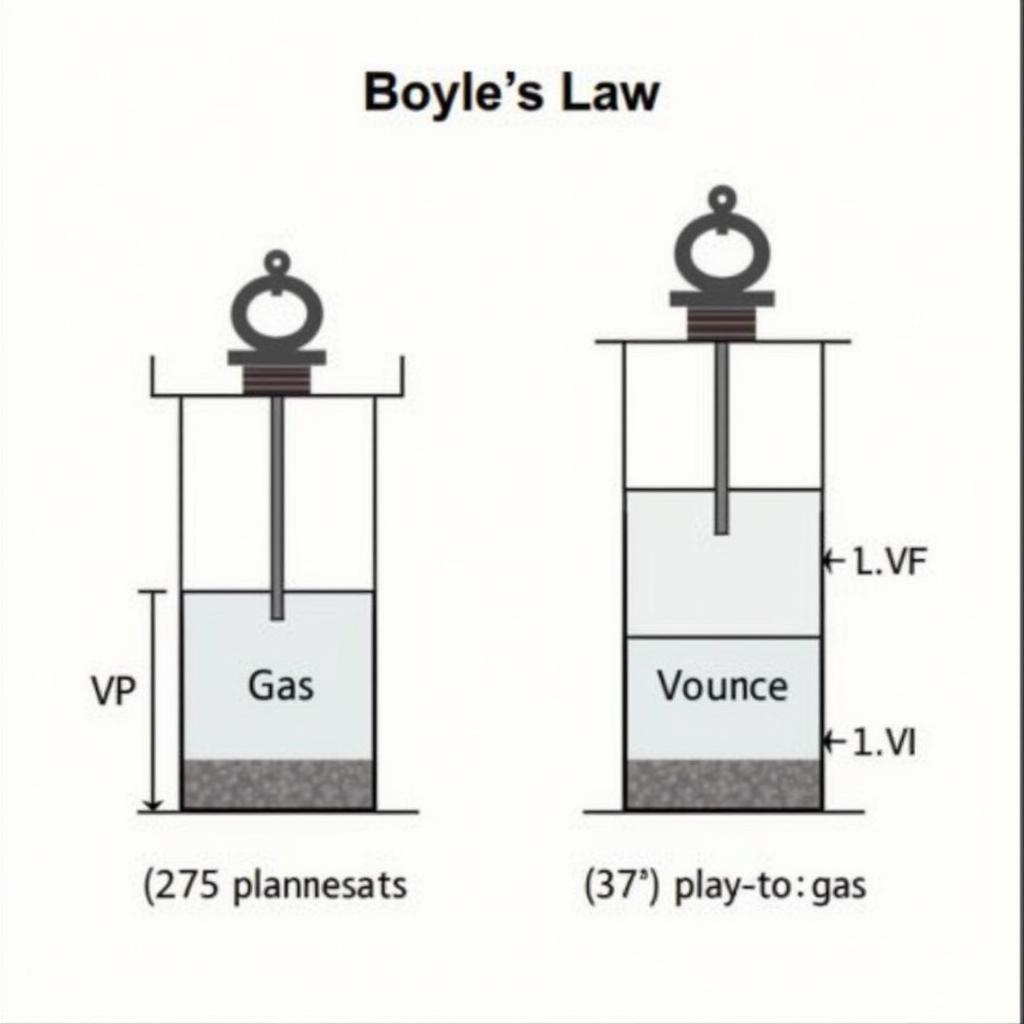
Định luật Boyle-Mariotte, được phát hiện bởi Robert Boyle và Edme Mariotte, khẳng định rằng ở nhiệt độ không đổi, tích của áp suất và thể tích của một lượng khí xác định là một hằng số.
Công thức: P₁V₁ = P₂V₂
Trong đó:
- P₁ và V₁ là áp suất và thể tích ban đầu của khí.
- P₂ và V₂ là áp suất và thể tích sau khi thay đổi.
 Minh họa định luật Boyle-Mariotte
Minh họa định luật Boyle-Mariotte
Ví dụ, nếu bạn giảm một nửa thể tích của một bình chứa khí ở nhiệt độ không đổi, áp suất của khí sẽ tăng gấp đôi.
Định luật Charles
Định luật Charles, được phát hiện bởi Jacques Charles, cho biết rằng ở áp suất không đổi, thể tích của một lượng khí xác định tỉ lệ thuận với nhiệt độ tuyệt đối của nó.
Công thức: V₁/T₁ = V₂/T₂
Trong đó:
- V₁ và T₁ là thể tích và nhiệt độ tuyệt đối ban đầu của khí.
- V₂ và T₂ là thể tích và nhiệt độ tuyệt đối sau khi thay đổi.
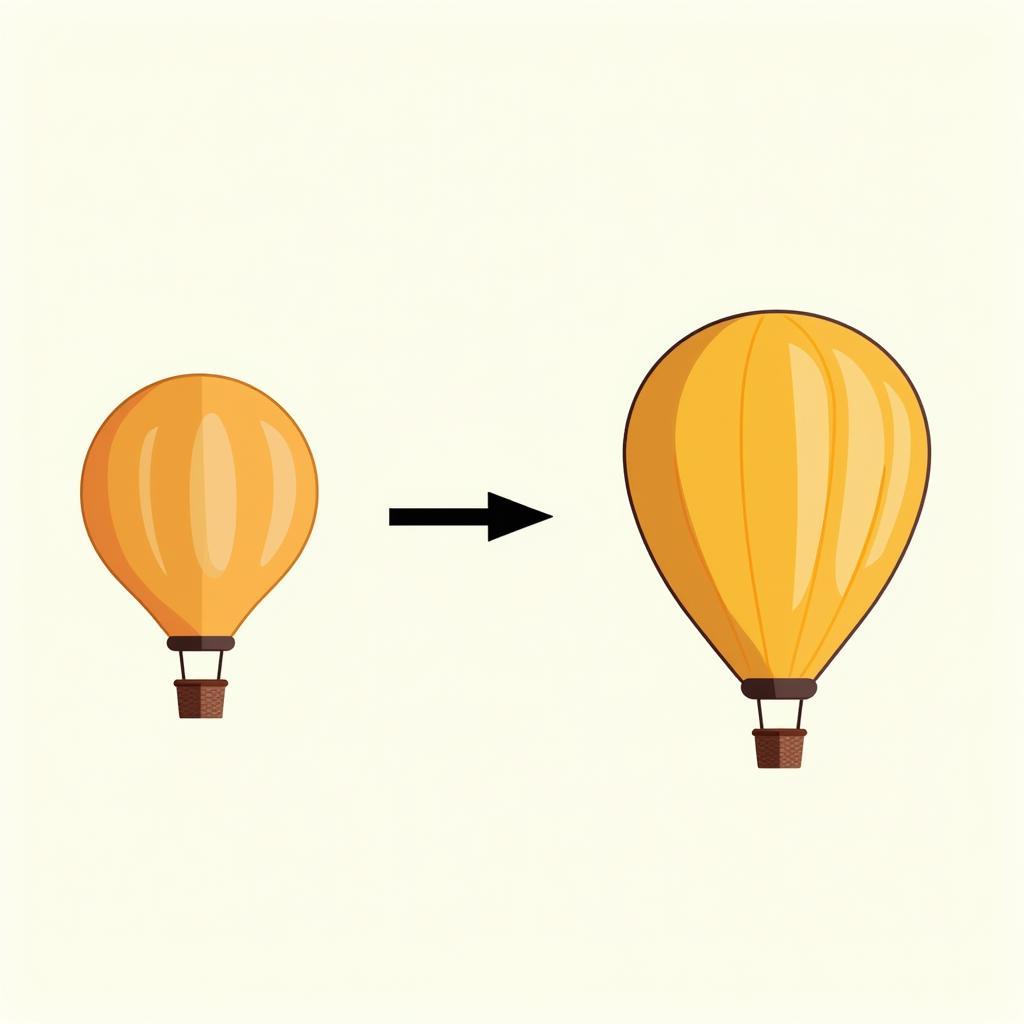 Mô tả định luật Charles
Mô tả định luật Charles
Ví dụ, nếu bạn tăng gấp đôi nhiệt độ tuyệt đối của một lượng khí ở áp suất không đổi, thể tích của nó cũng sẽ tăng gấp đôi.
Định luật Gay-Lussac
Định luật Gay-Lussac, được phát hiện bởi Joseph Louis Gay-Lussac, khẳng định rằng ở thể tích không đổi, áp suất của một lượng khí xác định tỉ lệ thuận với nhiệt độ tuyệt đối của nó.
Công thức: P₁/T₁ = P₂/T₂
Trong đó:
- P₁ và T₁ là áp suất và nhiệt độ tuyệt đối ban đầu của khí.
- P₂ và T₂ là áp suất và nhiệt độ tuyệt đối sau khi thay đổi.
Ví dụ, nếu bạn tăng gấp đôi nhiệt độ tuyệt đối của một lượng khí ở thể tích không đổi, áp suất của nó cũng sẽ tăng gấp đôi.
Phương trình Khí Lý Tưởng
Ba định luật trên có thể được kết hợp thành một phương trình duy nhất gọi là phương trình khí lý tưởng:
PV = nRT
Trong đó:
- P là áp suất của khí.
- V là thể tích của khí.
- n là số mol của khí.
- R là hằng số khí lý tưởng (0,0821 L.atm/mol.K).
- T là nhiệt độ tuyệt đối của khí.
 Giải thích phương trình khí lý tưởng
Giải thích phương trình khí lý tưởng
Phương trình khí lý tưởng cho phép chúng ta tính toán một trong các biến số của khí lý tưởng khi biết các biến số còn lại.
Ứng dụng của Các Định luật về Khí Lý Tưởng
Các định luật về khí lý tưởng có nhiều ứng dụng trong thực tế, bao gồm:
- Dự đoán hành vi của khí trong các điều kiện khác nhau: Ví dụ, trong ngành công nghiệp ô tô, các kỹ sư sử dụng các định luật về khí lý tưởng để thiết kế động cơ đốt trong.
- Tính toán lượng khí cần thiết cho một phản ứng hóa học: Ví dụ, trong ngành công nghiệp hóa chất, các nhà hóa học sử dụng các định luật về khí lý tưởng để sản xuất các loại khí khác nhau.
- Phân tích các hệ thống khí thực: Mặc dù khí thực không hoàn toàn tuân theo các định luật về khí lý tưởng, nhưng các định luật này vẫn cung cấp một mô hình gần đúng hữu ích cho nhiều ứng dụng thực tế.
Kết luận
Các định luật về khí lý tưởng là những công cụ quan trọng để hiểu và dự đoán hành vi của khí. Mặc dù chúng dựa trên một mô hình lý tưởng hóa, nhưng các định luật này vẫn cung cấp một cơ sở vững chắc cho nhiều ứng dụng thực tế trong khoa học và kỹ thuật. Để tìm hiểu thêm về các khía cạnh pháp lý liên quan đến các ngành công nghiệp sử dụng khí, bạn có thể tham khảo bộ luật thương mại và luật các tctd.




