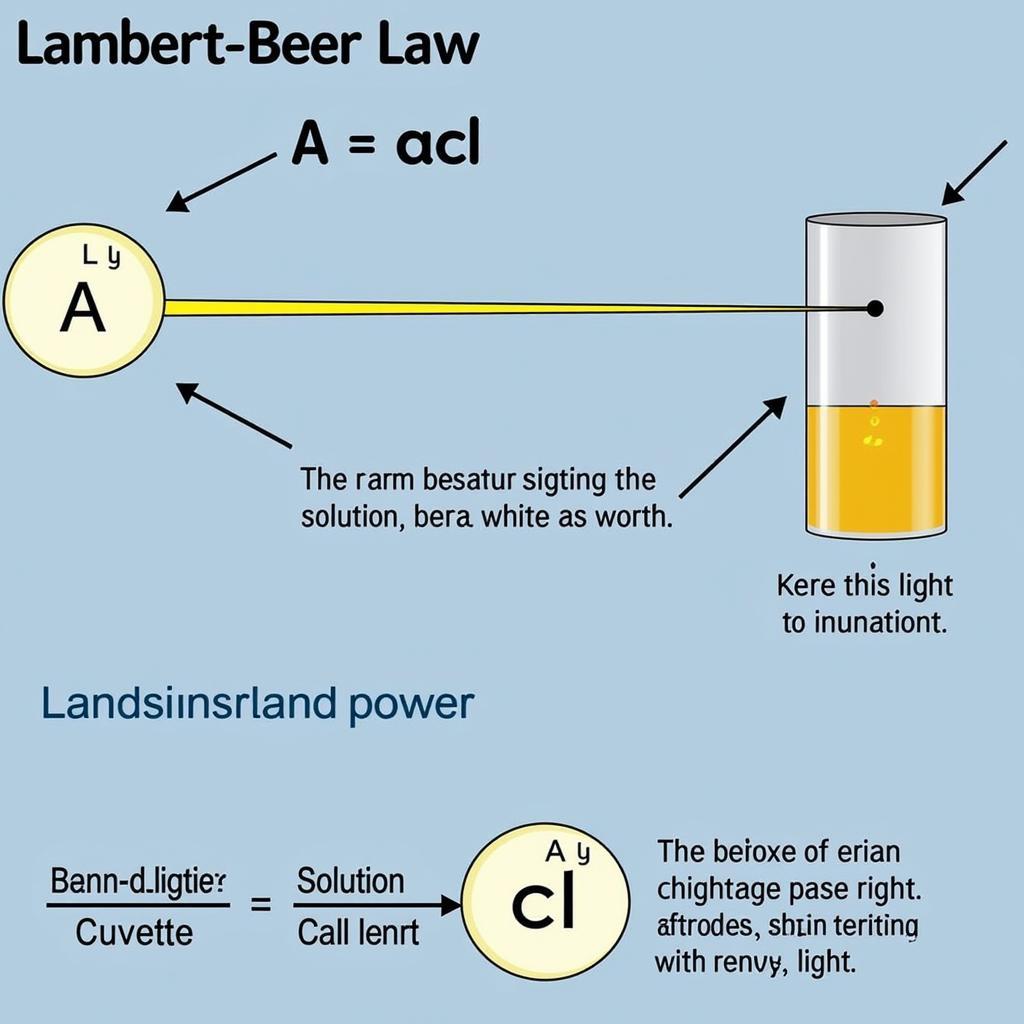
Công Thức Định Luật Lambert Beer
Công Thức định Luật Lambert Beer là một công cụ quan trọng trong nhiều lĩnh vực, từ hóa học phân tích đến vật lý quang học. Nó mô tả mối quan hệ giữa sự hấp thụ ánh sáng của một dung dịch và nồng độ chất tan cũng như chiều dài đường đi của ánh sáng. Bài viết này sẽ đi sâu vào công thức, ứng dụng và những lưu ý quan trọng khi sử dụng định luật Lambert-Beer.
Hiểu Rõ Định Luật Lambert-Beer
Định luật Lambert-Beer phát biểu rằng độ hấp thụ (A) của một dung dịch tỷ lệ thuận với nồng độ (c) của chất tan và chiều dài đường đi (l) của ánh sáng xuyên qua dung dịch. Hệ số tỷ lệ được gọi là độ hấp thụ mol (ε), một hằng số đặc trưng cho chất tan ở một bước sóng nhất định.
Công thức định luật Lambert Beer được biểu diễn như sau:
A = εcl
Trong đó:
- A: Độ hấp thụ (không có đơn vị)
- ε: Độ hấp thụ mol (L mol⁻¹ cm⁻¹)
- c: Nồng độ (mol L⁻¹)
- l: Chiều dài đường đi của ánh sáng (cm)
 Công thức Định Luật Lambert Beer
Công thức Định Luật Lambert Beer
Ứng Dụng của Công Thức Định Luật Lambert Beer
Công thức định luật Lambert Beer có nhiều ứng dụng thực tế, bao gồm:
- Xác định nồng độ chất tan: Đây là ứng dụng phổ biến nhất, cho phép xác định nồng độ của một chất chưa biết trong dung dịch bằng cách đo độ hấp thụ của nó.
- Nghiên cứu động học phản ứng: Định luật có thể được sử dụng để theo dõi sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm theo thời gian, từ đó xác định tốc độ phản ứng.
- Phân tích đa thành phần: Trong một số trường hợp, định luật có thể được áp dụng để phân tích hỗn hợp chứa nhiều chất tan.
- công thức định luật beer cũng được áp dụng trong nhiều lĩnh vực khác.
 Ứng Dụng Định Luật Lambert Beer
Ứng Dụng Định Luật Lambert Beer
Giới Hạn và Lưu Ý Khi Sử Dụng Định Luật Lambert-Beer
Mặc dù hữu ích, định luật Lambert-Beer có một số giới hạn cần lưu ý:
- Nồng độ cao: Định luật chỉ áp dụng cho dung dịch loãng. Ở nồng độ cao, tương tác giữa các phân tử chất tan có thể ảnh hưởng đến độ hấp thụ.
- Tán xạ ánh sáng: Sự tán xạ ánh sáng bởi các hạt lơ lửng trong dung dịch có thể dẫn đến kết quả không chính xác.
- Sự thay đổi nhiệt độ: Độ hấp thụ mol có thể thay đổi theo nhiệt độ, do đó cần kiểm soát nhiệt độ trong quá trình đo.
- báo bảo vệ pháp luật việt nam có thể cung cấp thông tin pháp lý liên quan.
Công Thức Định Luật Lambert Beer: Câu Hỏi Thường Gặp
Công thức định luật Lambert Beer là gì?
Công thức là A = εcl, mô tả mối quan hệ giữa độ hấp thụ, độ hấp thụ mol, nồng độ và chiều dài đường đi của ánh sáng.
Làm thế nào để áp dụng công thức này để xác định nồng độ?
Đo độ hấp thụ của dung dịch, biết độ hấp thụ mol và chiều dài đường đi, ta có thể tính nồng độ bằng cách sắp xếp lại công thức: c = A / (εl).
Định luật Lambert Beer có những hạn chế nào?
Một số hạn chế bao gồm nồng độ cao, tán xạ ánh sáng và sự thay đổi nhiệt độ.
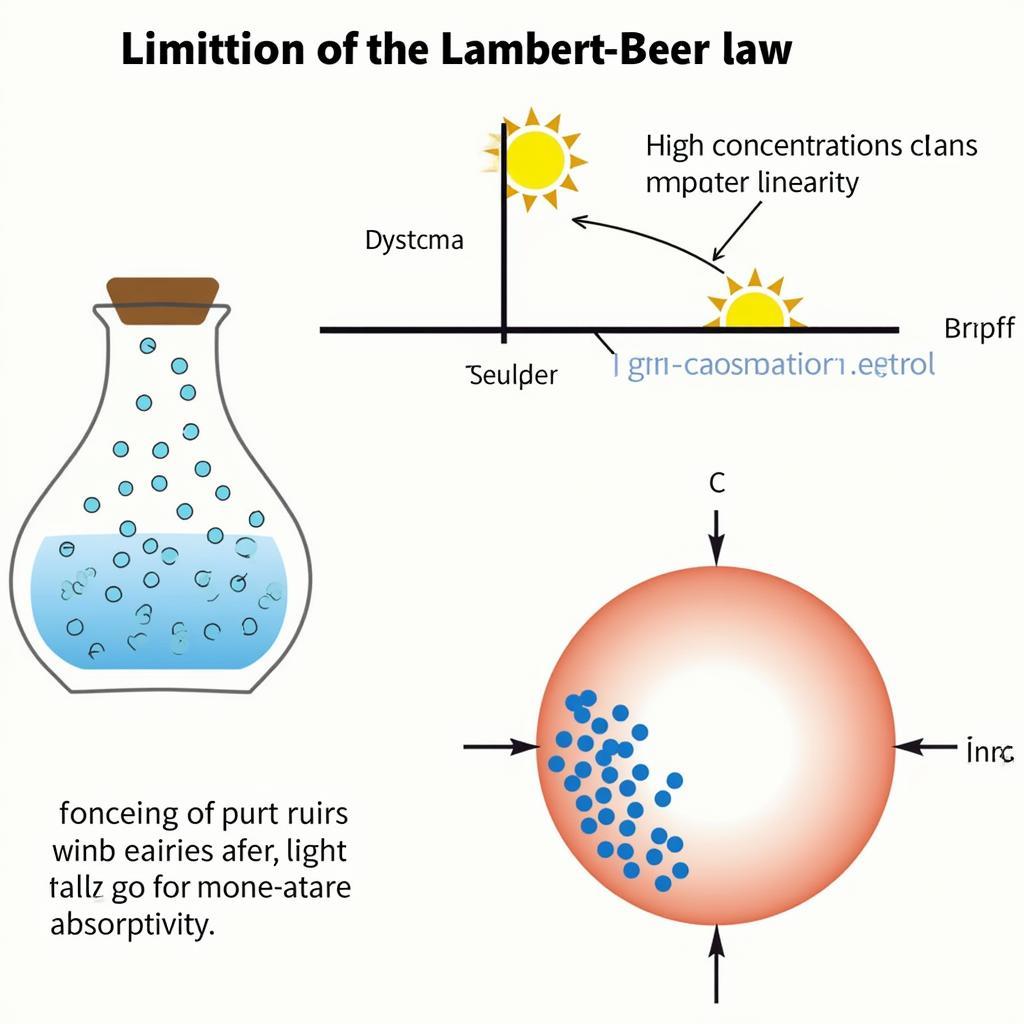 Hạn Chế Định Luật Lambert Beer
Hạn Chế Định Luật Lambert Beer
Kết luận
Công thức định luật Lambert Beer là một công cụ mạnh mẽ trong phân tích hóa học và nhiều lĩnh vực khác. Hiểu rõ công thức, ứng dụng và giới hạn của nó là điều cần thiết để áp dụng định luật một cách hiệu quả và chính xác. bài tập áp dụng định luật lambert-beer sẽ giúp bạn hiểu rõ hơn về định luật này. định luật beer lambert là một chủ đề quan trọng cần được nghiên cứu kỹ lưỡng. 4 định luật thuộc linh không liên quan đến bài viết này.
Khi cần hỗ trợ hãy liên hệ Số Điện Thoại: 0903883922, Email: [email protected] Hoặc đến địa chỉ: Đoàn Thị Điểm, An Lộc, Bình Long, Bình Phước, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.



