
Công Thức Định Luật Raoult: Khám Phá Chi Tiết
Công Thức định Luật Raoult là một khái niệm quan trọng trong hóa học, đặc biệt là trong lĩnh vực nghiên cứu dung dịch. Định luật này mô tả mối quan hệ giữa áp suất hơi của một thành phần trong dung dịch lý tưởng và áp suất hơi của thành phần đó ở trạng thái tinh khiết. các định luật raoult Hiểu rõ công thức này giúp ta dự đoán và giải thích nhiều hiện tượng liên quan đến dung dịch, từ việc xác định nhiệt độ sôi đến tính toán nồng độ các chất.
Định Luật Raoult là gì?
Định luật Raoult phát biểu rằng áp suất riêng phần của một thành phần trong dung dịch lý tưởng tỉ lệ thuận với phân số mol của thành phần đó trong dung dịch và áp suất hơi bão hòa của thành phần đó ở trạng thái tinh khiết. Nói cách khác, khi một chất tan không bay hơi được hòa tan vào dung môi bay hơi, áp suất hơi của dung môi sẽ giảm.
Công Thức Định Luật Raoult và Ứng Dụng
Công thức định luật Raoult được biểu diễn như sau:
- *PA = XA PoA**
Trong đó:
- PA: Áp suất riêng phần của thành phần A trong dung dịch.
- XA: Phân số mol của thành phần A trong dung dịch.
- PoA: Áp suất hơi bão hòa của thành phần A ở trạng thái tinh khiết.
Công thức này có nhiều ứng dụng thực tế, ví dụ như trong việc sản xuất rượu, chiết xuất hương liệu, và trong các quá trình công nghiệp khác.
Ứng dụng của Định luật Raoult trong Đời sống
Định luật Raoult không chỉ là lý thuyết suông mà còn có nhiều ứng dụng thiết thực trong đời sống hàng ngày. Ví dụ, việc pha chế nước hoa sử dụng nguyên tắc này để tạo ra mùi hương mong muốn. biểu thức định luật raout 2
 Ứng dụng Định luật Raoult trong đời sống
Ứng dụng Định luật Raoult trong đời sống
Theo chuyên gia Nguyễn Văn A, giảng viên Khoa Hóa học, Đại học Khoa học Tự nhiên: “Hiểu rõ định luật Raoult giúp chúng ta kiểm soát và tối ưu hóa nhiều quy trình công nghiệp.”
Độ lệch so với Định luật Raoult
Không phải tất cả dung dịch đều tuân theo định luật Raoult một cách lý tưởng. Có những dung dịch thể hiện độ lệch dương hoặc âm so với định luật. Độ lệch này phụ thuộc vào tương tác giữa các phân tử trong dung dịch. báo cáo thí nghiệm hóa lý định luật phân bố
Khi nào Định luật Raoult không áp dụng được?
Định luật Raoult chỉ áp dụng cho dung dịch lý tưởng. Trong thực tế, nhiều dung dịch thể hiện độ lệch so với định luật này, đặc biệt là ở nồng độ cao.
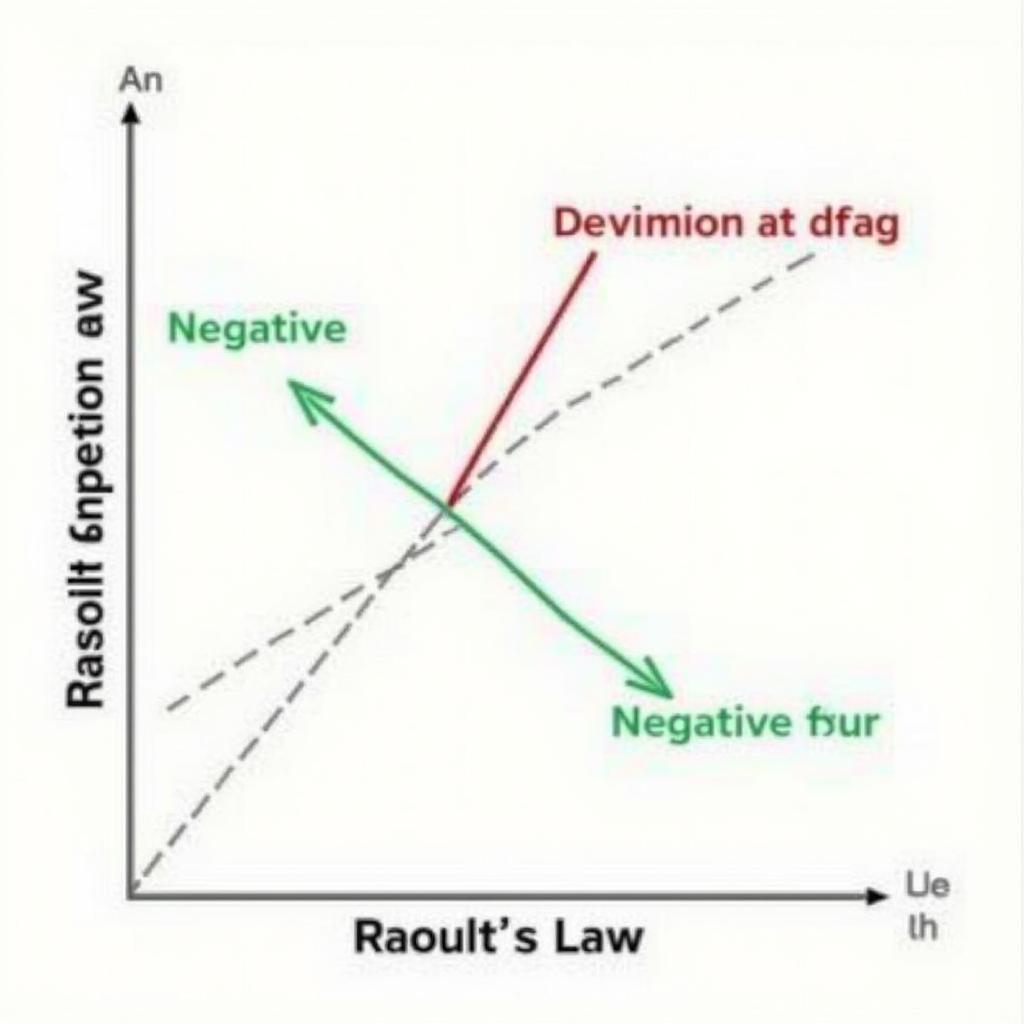 Độ lệch Định luật Raoult
Độ lệch Định luật Raoult
TS. Trần Thị B, chuyên gia hóa lý, nhận định: “Việc nghiên cứu độ lệch so với định luật Raoult cung cấp cái nhìn sâu sắc về bản chất của tương tác giữa các phân tử trong dung dịch.”
Kết luận
Công thức định luật Raoult là một công cụ quan trọng để hiểu và dự đoán tính chất của dung dịch. Mặc dù chỉ áp dụng cho dung dịch lý tưởng, nhưng nó vẫn là nền tảng cho việc nghiên cứu các hệ dung dịch phức tạp hơn. Nắm vững công thức định luật Raoult sẽ giúp bạn có cái nhìn tổng quan hơn về hóa học dung dịch. các giai đoạn áp dụng pháp luật
FAQ
- Định luật Raoult áp dụng cho loại dung dịch nào?
- Công thức định luật Raoult là gì?
- Ý nghĩa của PoA trong công thức là gì?
- Độ lệch so với định luật Raoult là gì?
- Ứng dụng của định luật Raoult trong thực tế là gì?
- Tại sao cần phải hiểu về định luật Raoult?
- Làm thế nào để tính phân số mol của một chất trong dung dịch?
Gợi ý các câu hỏi khác, bài viết khác có trong web.
- Bạn có thể tìm hiểu thêm về các định luật khác trong hóa học tại đây.
- Bài viết về áp suất hơi có thể giúp bạn hiểu rõ hơn về định luật Raoult.
Khi cần hỗ trợ hãy liên hệ Số Điện Thoại: 0903883922, Email: [email protected] Hoặc đến địa chỉ: Đoàn Thị Điểm, An Lộc, Bình Long, Bình Phước, Việt Nam. Chúng tôi có đội ngũ chăm sóc khách hàng 24/7.




